|
| Испарение и конденсация |
Пленочное кипение |
Сверхтекучий гелий |
Эксперименты | События | Библиотека |
Испарение и конденсацияПленочное кипениеСверхтекучий гелийЭксперименты События и мероприятияБиблиотека• История холода• Элементы физической кинетики• Разделение газовых смесей• Методические указания. Анализ криогенных установок• Оборудование гелиевого ожижителя Г-45• Методические указания. К практическим занятиям в криоцентре• Криогенные трубопроводы• Хранение и транпорт ожиженных газов• Основы методики проектирования криогенных установок• Вспомогательное оборудование криогенных установок• Расчет и оптимизация схем криогенных установок• Расчет низкотемпературных установок• Методика расчета схем криогенных установок (рефрижераторы и ожижители)• Методика расчета схем криогенных установок (рефрижераторы с нестационарными потоками)• Характеристики криогенных систем при работе на смесях• Механические свойства твердых тел при низких температурах• Людвиг Больцман. Лекции по теории газовСправочные данные БольцманиадаХейке Камерлинг-ОннесКриогениус |
Бродянский В.М. От твердой воды до жидкого гелия (история холода)2.2. КРИТИЧЕСКАЯ И ТРОЙНАЯ ТОЧКИСтремление найти температурную границу газообразного и жидкого состояний веществ привело к тому, что наступление на нее велось сразу с двух сторон – и «сверху» и «снизу». Если не считать отдельных частных попыток, то можно сказать, что решающий вклад в нахождение такой граничной температуры и определение свойств вещества в ней внесли два исследователя – Д.И. Менделеев и Т. Эндрюс. Первый подошел к ней «снизу» - от жидкости, изучая ее испарение, второй – «сверху» - от пара, изучая его ожижение. Лучше всего об этом написал сам Менделеев в главном своем труде «Основы химии». Характерно, как скромно пишет он о себе и как тщательно отмечает заслуги других: "Каньяр де-ла Тур, нагревая эфир в запаянной трубке около 190°, заметил, что при этой температуре жидкость сразу превращается в пар, занимающий прежний объем, т.е. имеющий плотность жидкости. Дальнейшие исследования Дриона, а также и мои, показали, что для всякой жидкости существует такая температура абсолютного кипения, ныне часто называемая критической температурой, выше которой жидкость не существует и превращается в газ". И далее: «...Если в жидкости исчезает сцепление молекул, она становится газом; ибо между этими двумя состояниями нет, кроме сцепления, иного коренного различия. Преодолевая его, жидкость при испарении поглощает теплоту. Поэтому температура абсолютного кипения определена мной (1861 г.) как таковая, при которой: а) жидкость не существует и дает газ, не переходящий в жидкость, несмотря на увеличение давления, б) сцепление равно нулю и в) скрытая теплота испарения равна нулю. Понятия эти мало распространялись, пока Эндрюс (1869 г.) не выяснил дело с другой стороны, именно, исходя из газов. Он нашел, что углекислый газ, при температурах, высших, чем 31°, не сгущается (т.е. не ожижается. - В. Б.) ни при каких давлениях, при низких же температурах может сжижаться. Температуру эту он назвал критической. Очевидно, что она тождественна с температурой абсолютного кипения».
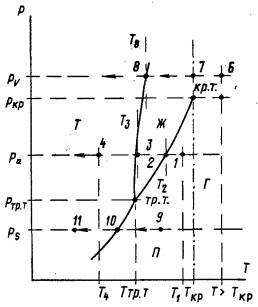
Тут все предельно ясно. Если газ имеет температуру выше критической, никаким сжатием его ожижить в принципе нельзя. Остается только один путь – понижение температуры. Следует добавить, что Т. Эндрюс (1813-1885 гг.) провел далее обширное исследование, заслуженно считающееся классическим, связанное со взаимными переходами газа и жидкости, С его работ, собственно, начинается теория ожижения газов. Он показал, в частности, что чем ниже температура и давление (т.е. чем дальше вещество от критической температуры), тем больше теплота конденсации (и соответственно парообразования). Интересно отметить, что Эндрюс, как и Менделеев, был химиком (а также и врачом – доктором медицины). С 1849 г. он был членом Лондонского Королевского общества. Было совершенно логично предположить, что и для перехода в твердое состояние тоже существуют соответствующие ограничения; они уже были известны применительно ко льду, воде и водяному пару, а затем подтвердились и на да оксиде углерода Оказалось, что для каждого вещества существует так называемая "температура тройной точки", определяющая нижнюю границу области возможного существования жидкости; за ней неизбежно происходит переход в твердое состояние. С чем связано название "тройная точка" и как связаны три состояния – твердое, жидкое и газообразное, можно видеть из диаграммы, показанной на рис. 2.7. На этой, так называемой "фазовой диаграмме", нанесены линии разделяющие области существования трех агрегатных состояний (фаз) вещества – твердого, жидкого и газообразного. Эти закономерности носят общий характер; меняются только конкретные для каждого вещества численные значения дав-лений и температур. Проследим, как изменяется состояние вещества с понижением его температуры Т при разных давлениях Р.
Начнем с пара, имеющего давление ра; его начальное состояние соответствует температуре Т1. Если его охлаждать, поддерживая давление ра постоянным, то при температуре Т2 он начнет конденсироваться и "не сдвинется" с точки 2 до тех пор, пока не перейдет целиком в жидкость. При этом от него должна быть отведена соответствующая "скрытая" теплота конденсации (если бы процесс шел в обратном направлении, то необходимо было 6ы подводить равную ей теплоту испарения). Далее между точками 2 и 3 жидкость будет охлаждаться от Т2 до Т3. В точке 3 произойдет затвердевание: вещество при постоянной температуре Т3 перейдет в твердое состояние; при этом будет отведена теплота затвердевания (или при обратном ходе процесса – плавления). Далее полученный лед1 можно охладить до любой нужной температуры, например до Т4. Совершенно иначе будет проходить процесс охлаждения газа с давлением ркр и с более высоким давлением (например, рv). Он перейдет в жидкость при критической температуре Ткр сразу, без отвода теплоты конденсации, которая равна в этих условиях нулю. Четкой границы между паром и жидкостью здесь нет. Например, пар, состояние которого соответствует точке 6, перейдет в точке 7 в жидкость сразу, без отвода "скрытой" теплоты конденсации. Дальше, при Т<Ткр жидкость будет охлаждаться обычным порядком и затвердевает при температуре Т8 (точка 8) с отводом соответствующей теплоты затвердевания. Далее можно охлаждать полученный лед тем же порядком, как и при р<ркр. Основываясь на понятии критической температуры, Эндрюс предложил разделить понятия "газы" и "пары". Газами при такой классификации называются вещества, находящиеся при температуре Т выше критической Ткр, т.е. вправо от линиии, идущей вниз от точки 7. Газы, как бы ни повышать давление, не переходят в жидкость (если их температура нe снижается). Напротив, паром называется газ при Т<Ткр; он может переходить в жидкое состояние и без снижения температуры, только в результате сжатия. Такое терминологическое разделение не связано с каким-либо качественным отличием во внутреннем строении газообразных веществ, но очень удобно практически; поэтому оно сохраняется и теперь. Рассмотрим в заключение третий случай охлаждения. Здесь при рс пар (например, точка 9) в результате охлаждения перейдет в точке 10 сразу в твердое состояние; образование жидкости здесь вообще исключено. Далее лед можно охлаждать до любой нужной температуры, например до Т11. Если напротив, двигаться в обратном направлении, соответствующем нагреванию, от точки 11 направо, то при Т10 произойдет испарение льда (сублимация) тоже без образования жидкости. В обоих случаях как при сублимации, так и при замораживании пара (десублимации) должно подводиться или соответствен но отводиться тепло ("скрытая теплота" сублимации или равная ей теплота десублимации). Классическим примером может служить "сухой лед" (твердый диоксид углерода СО2). При давлении 0,1 МПа его температура сублимации составляет -79°С. Переходя в пар, он поглощает соответствующее количество тепла, охлаждая, если нужно, какой-либо продукт, например мороженое. Единственные температура и давление, при котором одновременно могут существовать у каждого вещества все три состояния (отсюда – тройная точка): пар, жидкость и твердое тело (лед) - это Ттр.т. и ртр.т.Малейшее изменение температуры или давления вызывает исчезновение одной из фаз. Если точка, отражающая новое состояние, лежит на одной из линий, разделяющих три области, то будут соответственно существовать две фазы (Т+Ж, или Ж+П, или Т+П); при р и Т соответствующих всем остальным точкам, - только Т, Ж или П. В то время, о котором идет речь, обе точки – и критическая и тройная – были известны только для очень ограниченно круга веществ (в частности, для СО2). Однако каковы эти температуры для "постоянных" газов и каким термометрическим веществом можно воспользоваться для построения температурной шкалы в области ниже -110°С, было неясно. Очевидно стало, что нужно искать новые, более эффективные методы получения низких температур. Вместе с тем оставался открытым вопрос, как надежно их измерять. Речь шла не просто о достаточно трудном выборе термометрического вещества для столь низких температур. Вопрос стоял шире и выходил в то время за пределы низкотемпературной физики и техники. Нужна была некая "абсолютная" шкала, не зависящая от свойств того или иного термометрического вещества и простирающаяся до конца – тоже абсолютного нуля температур. В существовании такого абсолютного нуля уже никто не сомневался, но точно определить, где он находится, без абсолютной шкалы было невозможно. Эти вопросы были неразрывно связаны. Следующая страница: Взаимосвязь и разделение понятий тепла и температуры
|
|
Испарение и конденсация
Пленочное кипение
Сверхтекучий гелий
Эксперименты События Библиотека Справочники Больцманиада Камерлинг-Оннес Криогениус |
|
© Криофизика.рф 2006-2021. Молекулярно-кинетическая теория. Научные публикации. Испарение и конденсация. Плёночное кипение. Сверхтекучий гелий. |
о проекте условия использования |
контакты карта сайта |